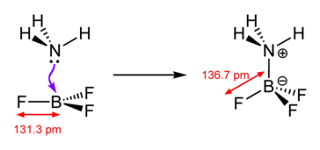Hola
descubridores de la química,
En una entrada
anterior os introduje el concepto de ácidos y bases de acuerdo con la teoría de
Brönsted y Lowry. Esta teoría se utiliza mucho en química, pero existe otra
teoría más completa, esta es la teoría de Lewis.
La teoría de
Brönsted y Lowry hablaba de aceptar y ceder protones. Pero la teoría de Lewis
va más allá y habla de densidad electrónica.
Un ácido de Lewis es un aceptor de pares electrónicos. Una base de Lewis es un dador de pares electrónicos. Aunque
actualmente en vez de hablar de pares electrónicos se prefiere hablar de
densidad electrónica.
Ejemplos de
ácidos de Lewis son los cationes (Ag+, NO2+),
compuestos con deficiencia electrónica (BF3), compuestos que pueden
expandir su octeto (SiF4), compuestos en los que el átomo central
tiene uno o más enlaces múltiples (CO2,SO3). Ejemplos de
bases de Lewis son, todos los aniones (Cl-,HS-),
moléculas con algún par electrónico no compartido (H2O,NH3),
alquenos y alquinos.
Reflexionando
sobre esto que acabo de escribir, el Ag+ al tener la carga positiva,
tiene poca densidad electrónica y por lo tanto puede aceptarla, será por tanto
un ácido de Lewis. El Cl- tiene mucha densidad electrónica (por la
carga negativa y se puede ver si dibujas la estructura de Lewis), será por
tanto una base de Lewis.
El amoníaco NH3
tiene un par solitario, que puede ceder, por lo tanto es una base de Lewis. El
BF3, el B tiene orbitales p disponibles a través de los cuales puede
aceptar densidad electrónica, por lo tanto es un ácido de Lewis.
Los ácidos y
bases de Brönsted y Lowry se pueden interpretar también con la teoría de Lewis.
Los ácidos de Brönsted exhiben acidez de Lewis porque: un protón puede aceptar
un par de electrones de una base de Lewis. Las bases de Brönsted también lo don
de Lewis.
Descubrirlaquimica. Estudiante
de química en la USC. Exalumna del Colégio Sagrado Corazón de Pontevedra. Miembro
SXGQ.
10 de Septiembre de 2019