Hemos visto dos tipos de enlace químico. El enlace iónico que se formaba con un elemento de la izquierda de la tabla periódica (metal) y otro elemento de la derecha de la tabla periódica (no metal) y el enlace covalente que se formaba con dos elementos de la derecha de la tabla periódica (es decir no metales). Por lo tanto nos falta por explicar el enlace formado entre elementos de la izquierda de la tabla periódica (es decir metales).
Si hacemos la configuración electrónica de un metal (por ejemplo el litio que es el más sencillo de ver) ¿Qué observamos? ¿Cumple la regla del octeto? No ¿Qué tiene que pasar para qué cumpla la regla del octeto? Tiene que perder un electrón.
Figura 1 - Configuraciones electrónicas del Li y del He
Pero en el enlace metálico no hay un único átomo de litio (o el metal o metales que correspondan) sino que hay varios átomos de litio.
Hemos visto dos situaciones:
I. Un átomo tiene que perder electrones y otro átomo tiene que ganar electrones (enlace iónico).
II. Los dos átomos tienen que ganar electrones, entonces los ganan compartiéndolos (enlace covalente).
III. Nos falta una única posibilidad ¿Cuál es? Para visualizarlo dibujaremos varios átomos de litio.
Figura 2 - Dibujo de varios átomos de litio
Los átomos tienen que perder electrones (pierden los electrones de valencia, en el caso del litio un electrón). Por lo tanto se forman iones positivos (cationes) ¿Qué pasa con esos electrones una vez qué son perdidos? Estos electrones de valencia tienen movilidad formando un “mar” en el que están inmersos los cationes.
Figura 3 - Diagrama del Li+. Teoría del mar de electrones. El verde representa la nube electrónica formada por el electrón perdido.
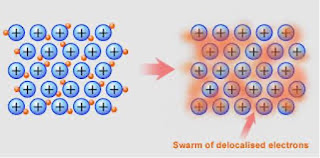
TEORÍA DEL MAR DE ELECTRONES
La teoría del mar de electrones es un modelo que describe la formación del enlace metálico. Describe al metal como una red cristalina de cationes inmersos en un “mar de electrones” de valencia. Los electrones están deslocalizados por el cristal iónico formando una nube como representa en la figura 4. La movilidad de los electrones de valencia hace que los metales sean buenos conductores del calor y la electricidad.
Figura 4 - Teoría del mar de electrones
PROPIEDADES DE LOS METALES
- Son sólidos a temperatura ambiente excepto el mercurio que es líquido. Antes en las casas era habitual encontrarse con termómetros de mercurio, en la figura 5 se puede ver uno, actualmente están prohibidos.
Figura 5 - Termómetro de mercurio
-Altas densidades, excepto los metales alcalinos. La química es el mundo de generalidades seguidas de excepciones, en este caso la generalidad son los metales y la excepción los metales alcalinos.
-Son muy duros, excepto los metales alcalinos. Nuevamente tenemos una generalidad seguida de una excepción.
-Altas temperaturas de fusión, excepto los metales alcalinos. Para pasar un metal de sólido a líquido hay que aplicar temperaturas extremadamente altas.
-Son dúctiles y maleables.
-Tienen alta conductividad eléctrica, esto lo explica la teoría del mar de electrones que se vio anteriormente.
-Son insolubles en agua y otros disolventes. Al tomar la sopa usamos cucharas, que están hechas de metal, y no se disuelven se mantienen tal y como estaban. Aunque si eres como Mafalda y no te gusta la sopa cambia la sopa por una infusión por ejemplo.
Figura 6 - Mafalda y la sopa
-Tienen una gran capacidad para reflejar la luz. Presentan brillo metálico por su gran capacidad de reflejar la luz, debido a la deslocalización y movilidad de los electrones.
En nuestro entorno cotidiano hay multitud de objetos cotidianos en los que podemos apreciar este brillo metálico.
Figura 7 - Brillo metálico en objetos cotidianos
13 de Abril de 2021
Descubrir La Química. Graduada en Química por la Universidad de Santiago de Compostela. Estudiante del Máster en Formación del Profesorado.