El perro es el mejor amigo del hombre - Posiblemente hayas escuchado muchas veces esta frase. Y es cierto ya que los perros son fieles a los hombres. Aunque no todos los hombres consideran al perro como su mejor amigo. Algunos prefieren a los gatos, a las serpientes, a los monos ... También hay a quien no le gustan lo perros, ni los animales.
 |
| El perro mejor amigo del hombre |
Pero hay una cosa que es cierta, para todos los químicos, y es que la tabla periódica es la mejor amiga del químico.
 |
| La tabla periódica es la mejor amiga del químico |
La tabla periódica es la piedra Rosetta de la naturaleza. Para el no iniciado es solo un centenar largo de recuadros numerados, cada uno de ellos con una o dos letras, dispuestos con una extraña simetría asimétrica. Pero para el químico revela los principios organizativos de la materia, es decir, los principios organizativos de la química. En un nivel básico, toda la química está contenida en la tabla periódica.
Eso no quiere decir, claro que toda la química resulte evidente a partir de la tabla periódica. Ni mucho menos. Sin embargo, la estructura de la tabla refleja la estructura electrónica de los elementos y por tanto sus propiedades químicas y su comportamiento. Lo más apropiado sería decir que toda la química comienza con la tabla periódica. (Rudy Baum, Número especial de CEEN sobre los elementos).
Hasta ahora he escrito muchos artículos de química y apenas he echo referencia a la mejor amiga del químico. En este artículo se rompe esto, vamos a conocer un poco a nuestra mejor amiga. Este artículo es un artículo de presentación, hay muchos aspectos sobre la tabla periódica que explicaré por encima, pero en posteriores artículos explicaré con más detalle.
¿CÓMO ES LA TABLA PERIÓDICA?
Es un conjunto de casillas, cada una de las cuales representa a un elemento. En cada casilla suele haber la siguiente información: Símbolo, número atómico y masa atómica. En algunas tablas periódicas se puede incluir el nombre del elemento y el estado o estados de oxidación, pero no tiene porque. Como buenos químicos tenemos que sabernos el símbolo de los elementos y saber sacar los estados de oxidación a partir de las posiciones en la tabla periódica.
La tabla periódica está estructurada en 18 columnas y 7 filas. LAS COLUMNAS SE LLAMAN GRUPOS Y LAS FILAS SE LLAMAN PERÍODOS. Esta última frase la he puesto en negrita y en mayúscula porque es muy importante. Hay mucha gente que no tiene claro que es un grupo (una columna) y un período (una fila) y es muy importante.
En un grupo de desciende o se asciende y en un período se avanza o bien de derecha a izquierda o de izquierda a derecha.
Los grupos tienen distintos nombres, que también es muy importante conocer:
- Grupo 1: Metales alcalinos.
- Grupo 2: Alcalinotérreos.
- Grupo 13: Terreos o boroideos
- Grupo 14: Carbonoides o carbonoideos.
- Grupo 15: Nitrogenoides o nitrogenoideos.
- Grupo 16: Anfígenos.
- Grupo 17: Halógenos.
- Grupo 18: Gases nobles.
- Elementos centrales: Metales del bloque d
- Elementos centrales excluyendo el grupo 12: Metales de transición
- Lantánidos y actínidos: Tierras raras.
Esto son palabras técnicas de química que debemos conocer ¿Por qué hago tanto hincapié en esto? Porque pueden ponerte un ejercicio de química realmente sencillo, pero por no saberte estos nombres técnicos tener que dejarlo en blanco.
En Junio de 2011, en la selectividad gallega calló un ejercicio que decía lo siguiente: Considerando el elemento alcalinotérreo del tercer período y el segundo elemento del grupo de los halógenos:
-Escriba sus configuraciones electrónicas y los cuatro números cuánticos posibles para el último electrón de cada elemento.
-¿Qué tipo de enlace corresponde a la unión química de estos elementos entre sí? Escriba la fórmula del compuesto que forman. Razona la respuesta.
Esa opción era realmente sencilla, mucha gente al no saberse los nombres técnicos, no sabía que se trataba de magnesio y cloro, dejó el ejercicio en blanco, se cambió de opción ... Si quieres entrar en una carrera que pidan poca media esto no importa mucho, pero, si quieres entrar en una carrera en la que pidan mucha media, no saber esto te puede fastidiar, eran 2 puntos lo que valía esta pregunta.
Así que ya sabes tienes que aprenderte los nombres técnicos, en selectividad aún puedes optar a la opción B. Pero ¿Y si no tienes opción B?
En la tabla periódica se distinguen: metales, no metales, semimetales, hidrógeno y gases nobles.
Si nos acercamos un poco podemos observar cuatro bloques:
- 2 columnas a la izquierda (bloque s).
- 10 columnas en el centro (bloque d).
- 6 columnas a la derecha (bloque p).
- 2 filas abajo (bloque f).
 |
| En este esquema se muestra de una manera gráfica los nombres de los bloques del sistema periódico |
El nombre de los bloques de la tabla periódica hace alusión al nombre del último orbital ocupado por los electrones de los elementos de ese bloque.
¿QUÉ CLASE DE ELEMENTOS HAY EN LA TABLA PERIÓDICA?
En el sistema periódico hay metales y no metales, que están separados por una especie de escalera de elementos, estos elementos se denominan semimetales.
Los metales se caracterizan por ejercer poca atracción sobre los electrones externos de sus átomos, tienen tendencia a perder electrones. Forman iones positivos.
Los no metales se caracterizan por atraer fuertemente a los electrones, tienen tendencia a ganar electrones. Forman iones negativos.
¿DE DÓNDE SALEN LOS NOMBRES Y SÍMBOLOS DE LOS ELEMENTOS DE LA TABLA PERIÓDICA?
Como observarás los elementos de la tabla periódica tienen nombres, nos referimos a ellos por el nombre del elemento o por el número atómico ... Para representarlos tienen símbolos.
No hay un criterio concreto para poner los nombres a los elementos de la tabla periódica. Estos han variado mucho a lo largo de los siglos.
Algunos son procedentes de nombres de dioses, como es el caso del prometio (que procede del Dios Prometeo). Otros proceden de nombres de planetas y cuerpos celestes, por ejemplo, el helio (que procede de helios, que significa sol).
Pueden proceder también, del nombre de un color característico. El cloro procede de Khloros, que significa en griego gas amarillo verdoso. El cesio proviene de caesius que significa azul en latín.
Otro motivo para darles nombre a los elementos, es el nombre del lugar donde vivía su descubridor. Por ejemplo: Polonio, Galio, Francio ... También puede aludir, lugares geográficos relacionados con los minerales en los que se descubrieron: erbio, terbio, iterbio e itrio.
Que te dediquen un elemento es un gran honor, puede ser por ser el descubridor del elemento o por que alguien te quiera honrar, esto es lo que ocurre con elementos como: bohrio, curio, einstenio ...
Los últimos elementos de la tabla periódica, hasta no hace mucho no se sabían sus nombres seguros y se nombraban siguiendo una sistemática derivada del latín.
Respecto a los símbolos de los elementos, tampoco hay unas reglas fijas para poner el símbolo. Los alquimistas utilizaban los símbolos de los planetas para representar a los elementos.
 |
| Símbolos de los alquimistas para designar a los elementos |
Pero estos símbolos pueden ser incomodos a la hora de escribir y además, en aquel entonces se conocían pocos elementos, pero actualmente conocemos 118 elementos, más los elementos que se descubran en el futuro. Hacer un dibujo para cada elemento puede resultar incomodo.
En 1813, Jöns Jacob Berzelius, solucionó este problema introduciendo el uso de los símbolos actuales.
Los símbolos pueden tener una letra: H,C,O,N,S,F,W... o dos letras: Cu, Na, Ag, Au ...
Hay símbolos que son obvios, por ejemplo Si,H,B,Br,Cl ... y otros símbolos no tan obvios: Cu, Na, Fe, Pb, Hg, Ag, Au, etc cuyos símbolos proceden de su nombre en latín. El tungsteno, se simboliza mediante W, del alemán wolfram (wolframio).
LA INFORMACIÓN QUE PUEDE SACAR UN QUÍMICO SOBRE UN ELEMENTO A PARTIR DE LA TABLA PERIÓDICA
Muchas de las propiedades de los elementos dependen de su configuración electrónica.
Si observamos el sistema periódico veremos que los elementos de un mismo grupo tienen la misma configuración electrónica externa, pero aumentando un nivel, por lo que tendrán propiedades químicas semejantes. Además, en cada período el número de electrones de la última capa varía entre 1 y 8, siendo lógico pensar que habrá una variación periódica de sus propiedades a medida que aumenta su número atómico.
La tabla periódica está llena de tendencias sistemáticas a lo largo de los grupos y períodos, hay excepciones, pero teniendo una idea de estas tendencias, se puede sacar mucha información de la tabla periódica. Estas tendencias se denominan propiedades periódicas, todas ellas tienen una explicación que daré en posteriores artículos. A continuación voy a dar algunos ejemplos de tendencias a lo largo de la tabla periódica y a decir como son sin dar una explicación.
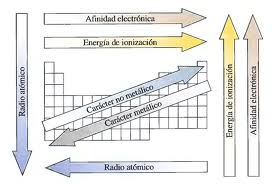
EL RADIO ATÓMICO: Relacionado con el volumen atómico, y a su vez relacionado con el tamaño atómico ya que los átomos se consideran esferas perfectas. El radio atómico aumenta al descender en un grupo y al avanzar de derecha a izquierda en un período.
ENERGÍA DE IONIZACIÓN: La energía de ionización es la energía mínima para arrancar un electrón de un átomo en fase gaseosa y en estado fundamental. La energía de ionización disminuye al descender en un grupo y al avanzar de izquierda a derecha en un período, es decir, al descender en un grupo y al avanzar de izquierda a derecha en un período es más fácil arrancarle electrones a un átomo.
AFINIDAD ELECTRÓNICA O ELECTROAFINIDAD: La afinidad electrónica o electroafinidad es la energía que libera un átomo en fase gaseosa y en estado fundamental cuando capta un electrón. La afinidad electrónica disminuye al descender en un grupo y de derecha a izquierda en un período, es decir al descender en un grupo y al ir de derecha a izquierda en un período es más fácil que los átomos capten electrones.
ELECTRONEGATIVIDAD: Es la tendencia que tiene un átomo, enlazado con otro, a atraer hacia el los electrones del enlace. La electronegatividad aumenta hacia la derecha en los períodos y hacia arriba en los grupos. El flúor es el átomo más electronegativo.
CARÁCTER METÁLICO: Los elementos no metálicos son muy electronegativos, tienen alta energía de ionización y tienden a formar aniones. Los metales son poco electronegativos, tienen baja energía de ionización y tienden a formar cationes. Por lo tanto podemos decir que el carácter metálico aumenta hacia la izquierda y hacia abajo en el sistema periódico. El carácter no metálico tiene la tendencia inversa.
A continuación un resumen de la variación de las propiedades periódicas:
¿CÓMO SE LLEGÓ AL SISTEMA PERIÓDICO ACTUAL?
El sistema periódico ha ido evolucionando desde que los griegos sugirieron la primera idea de clasificación de la materia hasta la actualidad.
Los griegos, en el siglo IV antes de Cristo fueron los primeros en plantearse una clasificación de la materia que les rodeaba. Afirmaban la existencia de cuatro elementos: tierra, aire, agua y fuego; y cuatro estados de la materia: frío, caliente, húmedo y seco.
22 siglos más tarde Döbereiner agrupó diversos elementos conocidos en su época en grupos de 3, a estos grupos se les denominó triadas, están ordenados en cada una de ellas de tal modo que las propiedades del elemento central son intermedias de las de los extremos o dicho de otra manera con una variación gradual del primero al último, así puso de manifiesto el notable parecido que había entre las propiedades de ciertos grupos de 3 elementos, esto fue alrededor del año 1817.
Hacia el año 1827 observó que había otros 3 grupos en los cuales se cumplía esta relación estos eran:
- Cl,Br,I.
- S,Se, Te.
- Li,Na,K.
Hacia el año 1850 ya se habían encontrado unas 20 triadas, esto indicaba una cierta regularidad entre los elementos químicos.
En la imagen se muestran algunas de las triadas de Döbereiner:

Döbereiner intentó relacionar las propiedades químicas de estos elementos con los pesos atómicos, observando una gran relación entre ellos, y una variación gradual del primero al último.
En su clasificación de las tríadas explicaba que el peso atómico promedio de los pesos los elementos extremos (suma de estos y división entre 2), es parecido, al peso atómico del elemento del medio.
Ejemplo:
La triada Cloro, Bromo, Iodo, cuyos pesos atómicos son respectivamente 36, 80, 127.
36 + 127 = 163
163 / 2 =81,5 que está cerca de 80 que es la masa atómica aproximada del bromo, lo que hace que concuerde un aparente ordenamiento de las triadas.
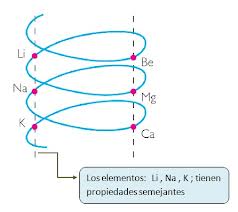
Poco después (hacia el año 1862) Chancourtois distribuyó los elementos en su caracol/tornillo/hélice/anillo telúric@ de tal modo que los elementos coincidentes en una generatriz formaban una triada, los elementos Li, Na y K quedan a un lado y el Be, Mg y Ca a otro. Los elementos de cada lado del caracol tienen propiedades similares.
A continuación se muestra el caracol telúrico de Chancourtois:
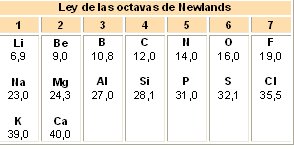
Más adelante hacia el año 1865 el químico inglés J.A Newlands que era un gran amante de la música, enunció una ley de octavas similar a la escala musical: “Si se colocan todos los elementos en orden creciente de masas atómicas, después de cada siete elementos aparece un octavo cuyas propiedades son semejantes a las del primero”. Consiguió ordenar algunas filas, pero no se conocían los gases nobles y no se encontraron sitios para los elementos recién descubiertos.
En la siguiente tabla se muestra la ley de las octavas de Newlands:
Hacia 1869 los químicos L.Meyer y D.Mendeléiev simultáneamente por separado organizaron los elementos conocidos según masas atómicas crecientes observando la semejanza que había entre aquellos de una misma columna.
Meyerse dio a sí mismo la tarea de crear la primera Tabla periódica de los elementos químicos. Pero cometió un error, no dejó un hueco cuando la ley descubierta no se cumplía por lo que si aparecía un elemento nuevo no lo podía colocar en su sistema periódico.
Mendeléiev “se llevó el merito” porque cuando en alguna ocasión la ley descubierta no se cumplía dejaba un huecopara un elemento desconocido, que al descubrirse tendría unas propiedades que anticipó. Al descubrirse el germanio y comprobarse que sus propiedades anticipadas coincidían extraordinariamente, la idea fue aceptada.
En esta imagen se muestra el sistema periódico de Mendeléiev:

Ya en el siglo XX alrededor de 1911 H.Mosseley ordenó los elementos conocidos según su número atómico Z creciente.
Alrededor de 1952 A.Werner y F.Paneth propusieron el sistema periódico actual, denominado el sistema periódico largo.
La tabla periódica y el químico son amigos para siempre
Descubrirlaquimica. Estudiante de química en la USC
29/07/2015
Esta entrada participa en el XLIV Carnaval de Química alojado en el